X、Y、Z、W四种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为17。其中W的阴离子核外电子数与Z原子的最内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Y、Z均能形成双原子分子。根据以上叙述,下列说法中正确的是
| A.以上四种元素的原子半径大小为X<Y<Z<W |
| B.X2W2、W2Y、WZ均为直线型的共价化合物 |
| C.W与Y形成的化合物W2Y2在化学反应中既可作氧化剂也可作还原剂 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为
A.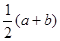 mol mol |
B.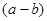 mol mol |
C.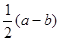 mol mol |
D.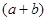 mol mol |
可逆反应mA(g)+nB(s) rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是
rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是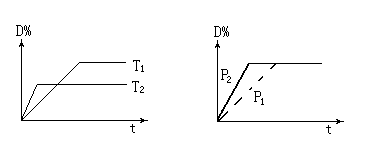
| A.温度降低,化学平衡向正反应方向移动 |
| B.使用催化剂,D的物质的量分数增加 |
| C.化学方程式系数m+n = r+q |
| D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动 |
下列化学用语的相关表述正确的是
| A.H+(aq)+OH-(aq)=H2O(l)△H="-a" kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ |
| B.因CuSO4·5H2O(s)=CuSO4(s)+5H2O(1)△H="+b" kJ/mol,故1 mol CuSO4(s)溶于足量水时,放出热量为b kJ |
| C.因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H="+c" kJ/mol |
D.因N2(g)+3H2(g) 2NH3(g)△H="-d" kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ 2NH3(g)△H="-d" kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
下列物质中的杂质(括号内为杂质)的检验、除杂的试剂或方法正确的是( )
| 物质及其杂质 |
检验 |
除杂 |
| A.Cl2(HCl) |
湿润的淀粉KI试纸 |
饱和食盐水 |
| B.NaHCO3溶液(Na2CO3) |
Ca(OH)2溶液 |
过量CO2 |
| C.CO2(HCl) |
AgNO3溶液(含稀硝酸) |
饱和Na2CO3溶液 |
| D. NO(NO2) |
观察颜色或湿润的淀粉KI试纸 |
水 |
已知 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为
A.404 B.260 C.230 D.200