下列叙述正确的是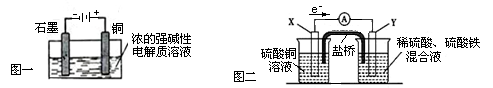
| A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 |
| B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成 |
| C.图二装置中发生:Cu+2Fe3+ = Cu2++2Fe2+,X极是负极,Y极材料可以是铜 |
| D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中 |
常温时,下列叙述正确的是
| A.pH=9的NH4Cl与NH3•H2O混合溶液中c(Cl-)>c ) |
| B.pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍 |
| C.AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D.1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小 |
下表中各组物质之间不能通过一步反应实现右图转化的是
| 甲 |
乙 |
丙 |
|
| A |
CH2=CH2 |
CH3CH2Cl |
CH3CH2OH |
| B |
SiO2 |
H2SiO3 |
Na2SiO3 |
| C |
Cl2 |
HCl |
CuCl2 |
| D |
AlCl3 |
Al(OH)3 |
Al2O3 |

下图是研究铁钉腐蚀的装置图,下列说法不正确的是
| A.铁钉在两处的腐蚀速率:a < b |
| B.a、b两处铁钉中碳均正极 |
| C.a、b两处铁钉中的铁均失电子被氧化 |
| D.a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O |
下列离子方程式不正确的是
| A.向AgCl悬浊液中加入Na2S溶液:2AgCl +S2- ="=" Ag2S+ 2Cl- |
| B.向NaHCO3溶液中加入NaOH溶液: HCO3-+OH- == + H2O |
| C.向Ba(OH)2溶液中加入稀H2SO4:Ba2+ + OH-+ H+ + ="=" BaSO4↓+ H2O |
| D.向Cu粉中加入过量的浓HNO3:Cu+4H+ +2="=" Cu2++2NO2↑+2H2O |
下图是制备和研究乙炔的性质实验装置图。下列说法不正确的是
A.制备乙炔的反应原理是CaC2+2H2O  Ca(OH) 2+C2H2↑ Ca(OH) 2+C2H2↑ |
| B.c的作用是除去影响后续实验的杂质 |
| C.d中的有机产物与AgNO3溶液混合能产生沉淀 |
| D.e中的现象说明乙炔能被高锰酸钾酸性溶液氧化 |