已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)=" 0.1" mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。当加入1.5mol铁粉并充分反应后的溶液中Fe(NO3)3、Fe(NO3)2、Cu(NO3)2物质的量浓度之比为( )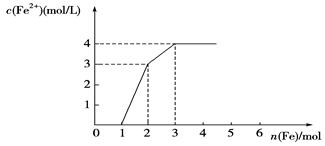
| A.1∶1∶1 | B.1∶3∶1 | C.2∶3∶2 | D.1∶1∶4 |
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2-、CO32-、NO3-七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失。下列判断正确的是 ( )
| A.一定不含Fe3+和Fe2+ |
| B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有 |
| C.溶液可能含有NO3- |
| D.一定含有Fe3+,但一定不含Fe2+ |
下列过程最终无沉淀产生的是()
| A.过量氨气通入Al2(SO4)3溶液 |
| B.CO2通入CaCl2溶液 |
| C.少量SO2通入BaCl2溶液后再通入过量Cl2 |
| D.过量CO2通入Na2SiO3溶液 |
现有mg如下化合物充分燃烧后,将其燃烧产物通入过量的过氧化钠固体,固体物质增加质量大于mg的是()
| A.CO | B.C2H4O2 | C.C3H6O2 | D.C3H4O4 |
下列实验方案不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,减重b克. |
| B.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克. |
| C.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体. |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |