下列说法正确的是( )
| A.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0ΔS>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
某炔烃与氢气加成得到2,3-二甲基戊烷,该炔烃可能的结构有
| A.1种 | B.2种 | C.3种 | D.4种 |
下列物质全部属于纯净物的是
| A.福尔马林、白酒、食醋 | B.甘油、氯仿、乙醇钠 |
| C.苯、汽油、无水乙醇 | D.二氯乙烷、聚氯乙烯、苯酚 |
下列说法正确的是
| A.常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 |
B.按系统命名法,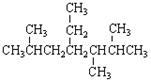 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 |
C.肌醇 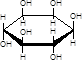 与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |
D.1.0 mol的  最多能与含5.0 molNaOH的水溶液完全反应 最多能与含5.0 molNaOH的水溶液完全反应 |
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些酸和醇重新组合可形成的酯共有
| A.40种 | B.32种 | C.28种 | D.15种 |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:
① 2FeCl3+10NaOH+3NaClO = 2Na2FeO4+9NaCl+5H2O
② Na2FeO4 + 2KOH ="=" K2FeO4 + 2NaOH
下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中NaClO 是氧化剂 |
| C.Na2FeO4 中Fe为+4价,具有强氧化性,能杀菌消毒 |
| D.若有2 mol FeCl3发生反应,转移电子的物质的量为 6 mol |