已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A.该溶液的pH=4 |
| B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
背景材料:①“神舟七号” 的防护层由聚四氟乙烯和玻璃纤维布组合而成;②光化学烟雾是导致珠三角地区空气质量下降的重要原因;③汞是有毒的金属;④据环境质量监测所抽查显示,新装修住房甲醛含量七成超标。⑤在广东、香港海域,渤海湾均出现过大面积的赤潮。据此判断,下列说法正确的是
(1)“神舟七号” 的防护层是复合材料,四氟乙烯属于不饱和烃。
(2)光化学污染主要是由氮氧化物和碳氢化物引起的。
(3) 打破水银温度计应撒上硫磺并扫干净
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象
| A.(1)(2)(3) | B.(1)(2)(5) | C.(2)(3)(5) | D.(2)(4)(5) |
金属钛对人体体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关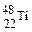 和
和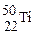 的说法中正确的是
的说法中正确的是
A.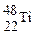 和 和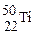 的质量数相同,互称为同位素 的质量数相同,互称为同位素 |
B.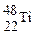 和 和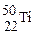 的质子数相同,互称同位素 的质子数相同,互称同位素 |
C.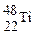 和 和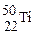 的质子数相同,是同一种核素 的质子数相同,是同一种核素 |
D.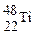 与 与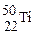 核外电子数相同,中子数不同,不能互称为同位素 核外电子数相同,中子数不同,不能互称为同位素 |
在容积为VK的密闭容器中发生2NO22NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。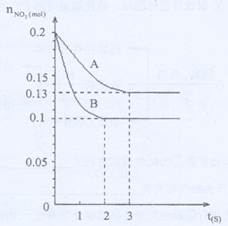
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是()
A.有、无催化剂B.温度不同C.压强不同D.V值不同
(2)写出该反应的化学平衡常数K的表达式,并比较K800℃K850℃(填>、<或=)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率VO2=。
(4)不能说明该反应已达到平衡状态的是()
A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
五种元短周期元素有关数据如表。其中的X是表示元素原子在分子内吸收电子能力的大小,X越大,原子吸引电子的能力越强,其最大值为4.0,最小值是0.7。试回答下列问题:
| 元素编号 |
A |
B |
C |
D |
E |
| X |
3.5 |
3.0 |
X3 |
1.5 |
1.5 |
| 主要化合价 |
-2 |
+7 |
+6 |
+3 |
+2 |
(1)X3的值应该为()
A.3.6 B.3.1C.2.5 D.1.4
(2)E元素在元素周期表中的位置是,B元素单质的电子式为。
(3)A元素的原子中有个未成对电子。A、B、C元素形成的单质中,结构微粒间作用力最强的是(写物质名称)。
(4)用一个化学反应可以证明B和C非金属性的强弱,写出该反应的化学方程式:
。
用一个化学反应也可以证明D元素和与D元素同周期且原子半径最大的元素(非零族)的金属性的强弱,写出该反应的离子方程式:
。
根据有关信息:2SO2(g)+O2(g)2SO3(g)+196.7KJ;某种硝酸钙晶体可表示为Ca(NO3)2·8H2O;25℃时NaHCO3的溶解度为9.6g/100g水;空气中氧气的体积分数为21%,判断下列有关数据正确的是
| A.室温下,配制2.5mol/L的NaHCO3溶液 |
| B.爆炸最强烈的坑道气中甲烷的体积分数为10.5% |
| C.用1molSO2气体与足量氧气反应放出的热量为98.35KJ |
| D.与CaO作用直接制Ca(NO3)2·8H2O所用硝酸的质量分数为50% |