依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是( )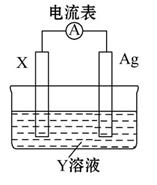
| A.电解质溶液Y是CuSO4溶液 |
| B.电极X的材料是Cu |
| C.银电极为电池的正极,其电极反应为Ag++e-=Ag |
| D.外电路中的电子是从X电极流向Ag电极 |
有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )
A.A3BC4 B.A2BC4 C.A2BC3D.ABC4
下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
| A.PCl3中P原子sp3杂化,为三角锥形 | B.BCl3中B原子sp2杂化,为平面三角形 |
| C.CS2中C原子sp杂化,为直线形 | D.H2S分子中,S为sp杂化,为直线形 |
在乙烯分子中有5个σ键和1个π键,下列说法正确的是( )
| A.乙烯与氢气发生加成反应,断裂的是σ键 |
| B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键 |
| D.乙烯分子中所有原子不共平面 |
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如下图: 。
。
已知该分子中 N-N-N 键角都是 108.1°,下列有关 N(NO2)3的说法正确的是( )
| A.分子中 N、O 间形成的共价键是非极性键 |
| B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 |
| D.15.2g 该物质含有 6.02×1022个原子 |
最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是( )
| A.CO2 | B.CH4O | C.COCl2 | D.H2O2 |