第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2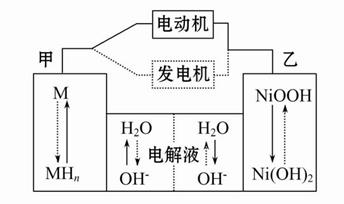
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH (填“增大”、“减小”或“不变”),该电极的电极反应式为 。
(2)Cu2O是一种半导体材料,可通过如图的电解装置制取,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是 。
用镍氢电池作为电源进行电解,当蓄电池中有1 mol H2被消耗时,Cu2O的理论产量为 g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的 腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的 (填“正”或“负”)极相连。
萤石(CaF2)晶体属于立方晶系,萤石中每个Ca2+被8个F-所包围,则每个F-周围最近距离的Ca2+数目为()
| A.2 | B.4 |
| C.6 | D.8 |
BaCl2是无色晶体,熔点963℃,沸点1560℃,溶于水,水溶液能导电。它可能属于________________晶体。
金属钾晶体为体心立方结构,则在单位晶胞中钾原子的个数是。
离子键的强弱主要决定于离子半径和离子电荷值,一般规律是:离子半径越小,离子电荷值越大,则离子键越强。试分析:①Na2O、② Al2O3、③MgO三种物质离子键由强至弱的顺序是(填序号)_____________________。
a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 |
a |
b |
c |
| 原子核数 |
单核 |
单核 |
双核 |
| 带电荷数 (单位电荷) |
0 |
1+ |
1- |
| d |
e |
f |
g |
| 多核 |
单核 |
多核 |
多核 |
| 0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:
(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为
>(用化学式表示)
(3)g微粒所构成的晶体类型属