下表是A、B、C、D、E五种有机物的有关信息:
| A |
①能使溴的四氯化碳溶液褪色; ②比例模型为 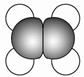 ③能与水在一定条件下反应生成C |
| B |
①由C、H两种元素组成。 ②球棍模型为 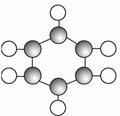 |
| C |
①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D |
①相对分子质量比C少2; ②能由C催化氧化得到 |
| E |
①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是___________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______________。
(3)C催化氧化生成D的化学方程式为_________________________________。
(4)有机物B具有的性质是__________ (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是________________________(用化学方程式说明)。
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
B |
||||||
| D |
E |
F |
|||||
| C |
I |
G |
H |
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图
(2) 稳定性比较:D的氢化物G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为_____
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式________________
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:_______________________飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
(6)举一例说明C和I金属性的强弱
(7)用电子式表示由I和H组成的化合物的形成过程
等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为______,B的平均反应速率为______,x的值是______。
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L·min),则5min时,A的浓度为______,B的平均反应速率为______,x的值是______。
(1)今有氢氧燃料电池,则正极通入的气体是________,负极通入的气体是________,电解质溶液为稀硫酸时,电极反应式为:正极______________负极________________,电池的总反应式为
(2)如把H2改为甲烷、KOH作导电物质,则电极反应式为:负极________________
在一容积固定的密闭容器中进行的反应:N2(g)+3H2(g)≒2NH3(g),,达到平衡状态的标志是
①单位时间内生成n m ol N2的同时生成2n mol NH3
ol N2的同时生成2n mol NH3
②氨的生成速率与氨的分解速率相等
③用N2、H2、NH3的物质的量浓度变化表示的反应速率的比为1∶3∶2的状态
④N2、H2、NH3浓度相等
⑤断开1个N≡N键的同时有6个N-H键形成
⑥混合气体的密度不再改变的状态
⑦混合气体的压强不再改变的状态
⑧混合气体的平均相对分子质量不再改变的状态
⑨反应放出的热量等于反应吸收的热量
(4分)非金属元素R,其单质4.8g在氧气中充分燃烧生成RO29.6g,在R原子中,核内质子数等于中子数,则R的元素名称为,其最高价为,与上下左右相邻元素比较,R的最高价氧化物的水化物酸性比弱。用 形式表示该元
形式表示该元 素的原子。
素的原子。