下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;F的结构式为 。
(2)A与B反应的化学方程式为 。
(3)E与G的稀溶液反应的离子方程式为 。
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
(1)铅蓄电池放电时发生下列反应负极:Pb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,用该电池电解CuSO4溶液,当有纯铜1.6g析出时,铅蓄电池内消耗硫酸物质的量为_______。
(2)锌、溴蓄电池的充、放电的电池总反应为Zn+Br2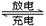 Zn2++2Br-。下列各反应①Zn-2e-====Zn2+②Br2+2e-====2Br-③2Br--2e-====Br2④Zn2++2e-====Zn,其中充电时的阳极反应式为,放电时负极的反应式是。
Zn2++2Br-。下列各反应①Zn-2e-====Zn2+②Br2+2e-====2Br-③2Br--2e-====Br2④Zn2++2e-====Zn,其中充电时的阳极反应式为,放电时负极的反应式是。
(3)目前人们正研究开发一种高能电池一—钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β,,——Al2O3陶瓷作固体电解质,反应如下:2Na+xS 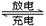 Na2Sx,其正极反应式为,当外电路转移4mol电子时消耗硫单质的质量为。
Na2Sx,其正极反应式为,当外电路转移4mol电子时消耗硫单质的质量为。
工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应:阳极阴极:;
(2)写出Cr2O72-转变成Cr3+的离子反应方程式;
(3)电解过程中Cr(OH)3、Fe(OH)3沉淀是怎样产生的?。
从H+、Na+、Cu2+、Ba2+、Cl—、SO42—离子中,选出恰当的离子组成一种电解质,将电解质溶液按下列要求进行电解(均是惰性电极):
(1)电解时电解质含量减小,水量不变,则所采用的电解质是;
(2)电解时电解质的质量保持不变,水量减小,则所采用的电解质是;
(3)电解时电解质和水的质量都发生变化,则所采用的电解质是;
(9分)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇(CH3OH)和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢或锂电池的十倍,可连续使用一个月才充一次电。据此请回答以下问题:
(1)甲醇是极,电极反应是;
(2)电池反应的离子方程式是;
(3)用该甲醇电池电解100 ml 0.4 mol/L的CuCl2溶液,当电池消耗0.3克甲醇时,电解池的阴极析出克(物质的化学式),若要恢复CuCl2溶液至原状,需加入克(填物质的化学式)。
(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为________________________。
(2)已知难溶电解质溶解平衡时M(OH)2(s) M2+(aq) +2OH— (aq),溶液的pH=a,则其Ksp=。
M2+(aq) +2OH— (aq),溶液的pH=a,则其Ksp=。
(3)溶液的酸度表示为AG=lg[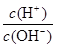 ],又知100℃时,水的离子积常数为1×10—12,25℃时纯水的AG1和100℃时食盐水的AG2的关系为:AG1AG2(=、<、>);在100℃时将V1ml AG=8的硫酸与V2ml AG=—6的烧碱溶液混合后AG=0,则V1:V2=。
],又知100℃时,水的离子积常数为1×10—12,25℃时纯水的AG1和100℃时食盐水的AG2的关系为:AG1AG2(=、<、>);在100℃时将V1ml AG=8的硫酸与V2ml AG=—6的烧碱溶液混合后AG=0,则V1:V2=。