用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.24 g NaH中阴离子所含电子总数为NA |
| B.标准状况下,22.4 L苯中含有C—H键数目为6NA |
C.在碳酸钠溶液中,若c(C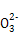 )="1" mol/L,则c(Na+)="2" mol/L )="1" mol/L,则c(Na+)="2" mol/L |
| D.通过MnO2催化使H2O2分解,产生32 g O2时转移电子数为2NA |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是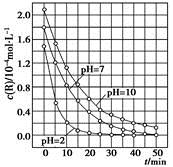
| A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |
相同温度下,在水中分别加入下列物质,若用Kw表示水的离子积,a表示水的电离程度,能使a/Kw的值增大的是
| A.NaOH | B.NaHSO4 | C.HC1 | D.NH4NO3 |
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向纯水中加人少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变 |
250C时,pH=3的HNO3,下列该硝酸说法正确的是
| A.该硝酸中水电离出的c(H+)=1.0×10-3mol/L |
| B.加水稀释到原溶液体积的100倍,硝酸溶液的pH为5 |
| C.相同温度下,pH=3的CH3COOH溶液的物质的量浓度与该硝酸相同 |
| D.该硝酸中加入少量的Zn粒产生H2 |
下列叙述不正确的是
| A.向纯水中加入少量CH3COONa固体,促进了水的电离 |
| B.25°C 时,pH=3的醋酸与pH=3的HCl对水的电离抑制作用相同 |
| C.25°C时,pH=3的NH4Cl溶液中,水电离出的c(H+)是10-3mol/L |
| D.升高温度,纯水电离出的c(H+)增大,pH减少,显酸性 |