水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2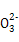 +O2+aOH-
+O2+aOH- Y+S4
Y+S4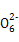 +2H2O,下列说法中,不正确的是( )
+2H2O,下列说法中,不正确的是( )
| A.a=4 |
| B.Y的化学式为Fe2O3 |
C.S2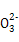 是还原剂 是还原剂 |
| D.每有1 mol O2参加反应,转移的电子为4 mol |
下列实验操作与实验目的相符的是()
| 序号 |
实验操作 |
实验目的 |
| A |
测定HF、HCl的熔点、沸点 |
比较F、Cl的非金属性强弱 |
| B |
MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 |
比较镁、铝的金属性强弱 |
| C |
将SO2气体通入碳酸钠溶液中 |
比较碳、硫的非金属性强弱 |
| D |
向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 |
比较NaOH、NH3·H2O、Al(OH)3的碱性强弱 |
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,正确的是 ( )
| A.原子半径:X>Y>Z>W |
| B.原子序数:Y>X>Z>W |
| C.原子最外层电子数:Y>X>Z>W |
| D.金属性:X<Y,还原性:W2->Z- |
若阿伏加德罗常数的数值用NA表示,下列说法正确的是()
| A.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
| B.1.6gNH2-离子所含质子数为NA |
| C.50mL18.4mol·L—1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
有关晶体的下列说法中正确的是
| A.晶体中分子间作用力越大,分子越稳定 |
| B.原子晶体中共价键越强,熔点越高 |
| C.冰熔化时水分子中共价键发生断裂 |
| D.氯化钠熔化时离子键未被破坏 |
元素性质的周期性变化不包括
| A.原子半径 | B.元素的主要化合价 |
| C.原子核外电子结构 | D.金属性和非金属性 |