某工业反应为:X2(g)+3Y2(g) 2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。
2XY3(g)。图Ⅰ表示在一定温度下此反应过程中的能量变化;图Ⅱ表示在2 L的密闭容器中反应时X2的物质的量随时间的变化曲线;图Ⅲ表示在其他条件不变的情况下,改变起始物Y2的物质的量对此反应平衡的影响。
下列说法正确的是( )
| A.由图Ⅰ可知,加入适当的催化剂,E和ΔH都减小 |
| B.图Ⅱ中0~10 min内该反应的平均速率v(Y2)="0.045" mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(X2)的变化曲线为d |
| C.图Ⅲ中a、b、c三点所处的平衡状态中,反应物X2的转化率最高的是b点 |
| D.图Ⅲ中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则T1<T2,K1<K2 |
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
| A.1∶1 | B.2∶1 | C.1∶2 | D.2∶3 |
下列各种环境下的离子组能大量共存的是
A.pH=1的溶液中:K+、Fe2+、Cl-、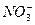 |
B.强碱性溶液中:Na+、K+、[Al(OH)4]-、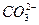 |
C.中性溶液中:Na+、Ca2+、Cl-、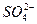 |
D.使蓝色石蕊试液变红的溶液中: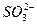 、 、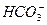 、Na+、K+ 、Na+、K+ |
从海水中可以提取溴,主要反应为2Br-+Cl2====2Cl-+Br2,下列说法正确的是
| A.溴离子具有氧化性 |
| B.氯气是还原剂 |
| C.该反应属于复分解反应 |
| D.氯气是氧化剂 |
2007年1月27日上午,安徽省广德县一名六岁男孩因父母外出买菜,想喝饮料时却误服了“84”消毒液。幸好家人发现,经医院抢救,患儿仅是咽部红肿。市场上销售的“84”消毒液,其商品标识上注明:①本品为无色液体呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是
| A.Cl2 | B.H2SO4 | C.NaClO | D.KMnO4 |
现有100 g 5.3%的碳酸钠溶液和100 g 2.74%的稀盐酸:(1)将碳酸钠溶液缓慢滴入盐酸中,(2)将稀盐酸缓慢滴入碳酸钠溶液中,则两种操作所产生的气体质量关系为
| A.均是1.65 g | B.均是1.49 g | C.(1)>(2) | D.(2)>(1) |