(1)某小组为研究电化学原理,设计如图装置,下列叙述正确的是 。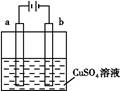
| A.若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-=Cu |
| B.若a和b为石墨,通电后滴入酚酞,a电极附近溶液呈红色 |
| C.若a为铜,b为铁,通电后Cu2+向a电极移动 |
| D.若a为粗铜,b为纯铜,通电后b电极质量增加 |
(2)电镀时,镀件与电源的 极连接。化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。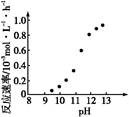
Al3+ + 3H2O Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是
Al(OH)3 + 3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH值增大,应采取的措施是
| A.加热 | B.加适量NaOH溶液 | C.通入氯化氢气体 | D.加入固体三氯化铝 |
下列对化学反应的认识正确的是
| A.化学反应过程中,分子的种类和数目一定发生改变 |
| B.化学反应过程中,一定有化学键的断裂和形成 |
| C.放热反应的反应速率,一定比吸热反应的反应速率快 |
| D.如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
对于0.1 mol/L的醋酸溶液,下列说法正确的是
| A.加水稀释后,溶液中c(H+)和c(OH-)都减少 |
| B.温度升高后,溶液的pH增大 |
| C.加入少量Na2CO3固体,醋酸电离平衡向左移动 |
| D.加入少量冰醋酸后,溶液的c(H+)增大 |
为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)不变 |
| B.加入少量水,v(H2)减小 |
| C.加入CH3COONa固体,v(H2) 不变 |
| D.滴加少量CuSO4溶液,v(H2)减小 |
下列离子方程式正确的是
| A.向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2—+2H2O |
| B.向硅酸钠溶液中滴加盐酸制取硅酸:SiO32—+2HCl=H2SiO3↓+2Cl— |
| C.Ba(OH)2溶液中滴加少量NH4HCO3溶液: NH4++HCO3-+2OH-+Ba2+=NH3·H2O+H2O+BaCO3↓ |
D.用惰性电极电解饱和食盐水:2Cl-+ 2H+ H2↑ + C12↑ H2↑ + C12↑ |