某化学兴趣小组用铝土矿(主要成分为A12 O3,还含有SiO2及铁的氧化物)提取氧化铝作冶炼铝的原料,提取的操作过程如下: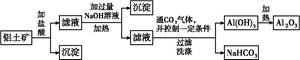
(1)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有 ;洗涤沉淀的操作是 。
(2)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式: ,此方案中所用药品的物质的量之比是:n(Al)∶n(H2SO4)∶n(NaOH) = 。
(3)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出铁元素的价态为+3的结论。请指出该结论是否合理并说明理由 。
下图是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)="=" ZnSO4(aq) + Cu(s)。若该电池中两电极的总质量为300g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为298g。

请回答以下问题:
⑴R的名称是___________,其作用是__________________。R中的阳离子移向___________(填A或B)中的溶液。
⑵电极Y的材料是________,B中的电解质溶液是________________。
⑶X为原电池的___极,其电极反应式是______________。
(4)产生铜的质量为;转移的电子的物质的量为。
(5)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Fe电极作极(填“阴”或“阳”);
② Ni电极的电极反应式为:。
化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内________________变化来测定该反应的速率;在Na2S2O3+H2SO4→Na2SO4+S↓+SO2↑+H2O反应中,该反应的速率可通过___来测定。
某化学反应的反应物和产物如下:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2应的氧化剂是。
该反应的氧化产物是。
反应过程中转移5mole,生成标况下N2的体积L。
配平该反应的化学方程式:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2
t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白,并利用三段式写出①②的计算过程。
①从开始反应至达到平衡状态,求反应物A的平均反应速率和A的转化率。
②求x的值和t℃该反应的平衡常数K的值。
③若向原平衡混合物的容器中再充入4 mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=mol。
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内A的平均速率为_________mol/(L·min)。
(2)在实验2,A的初始浓度c2=_________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_________。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3_________υ1(填>、=、<),且c3_________1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是_________反应(选填吸热、放热)。理由是:
______________________________________________________________________