下述实验能达到预期实验目的的是( )
| 序号 |
实验内容 |
实验目的 |
| A |
室温下,用pH试纸测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
| B |
向盛有1 mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C |
向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 |
验证两者都发生了水解反应,且相互促进 |
| D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
汽车尾气净化中的一个反应如下:NO(g)+CO(g)
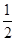 N2(g)+ CO2(g) ΔH=-373.4kJ·mol-1在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
N2(g)+ CO2(g) ΔH=-373.4kJ·mol-1在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
| A.达到平衡后,若只升高温度,化学平衡正向移动 |
| B.达到平衡后,再通人稀有气体,逆反应速率增大 |
| C.使用催化剂,平衡常数不变 |
| D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1 |
在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
| A.H2、I2、HI的分子数之比为1∶1∶2 |
| B.混合气体的颜色不再发生变化 |
| C.单位时间生成n mol H2,同时消耗成2n mol HI |
| D.混合气体的密度保持不变 |
根据如图所示的装置,判断下列说法不正确的是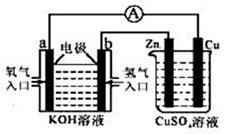
| A.该装置中铜为阳极 |
| B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| C.该装置中b极的电极反应式是:H2+2OH--2e-== 2H2O |
| D.该装置中a极为正极,发生氧化反应 |
下列叙述正确的是
① 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
② 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③ 电镀时,应把镀件置于电解槽的阴极
④ 冶炼铝时,用电解熔融氧化铝的方法
⑤ 钢铁表面常易锈蚀生成Fe2O3•nH2O
| A.①②③④⑤ | B.①③④⑤ | C.①③⑤ | D.②④ |
观察下列几个装置示意图,有关叙述正确的是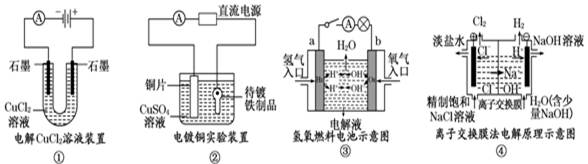
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③中外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |