某小组取一定质量的FeSO4固体,利用下图装置进行实验。
| 实验 |
实验过程 |
实现现象 |
| ① |
通入一段时间N2,加热 |
A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② |
用带有火星的木条靠近装置D的导管口 |
木条复燃 |
| ③ |
充分反应,停止加热,冷却后,取A中固体,加盐酸 |
固体溶解,溶液呈黄色 |
| ④ |
将③所得溶液滴入D试管中 |
溶液变为浅绿色 |
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯
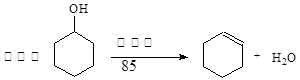
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后,用 (填编号)洗涤环己烯。
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按下图装置蒸馏,冷却水从 (填f或g)口进入,蒸馏时要加入生石灰,目的是 。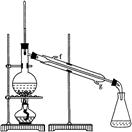
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 。
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是 。
A.酸性KMnO4溶液 B.用金属钠 C.测定沸点 D.溴的四氯化碳溶液
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃。某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去)。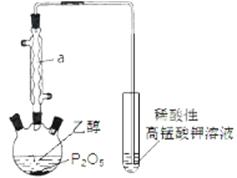
(1)仪器a的名称为 。
(2)用化学反应方程式表示上述制备乙烯的原理 。
(3)已知P2O5是一种酸性干燥剂,吸水放出大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为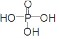 )
)
。
(4)该装置中还缺一种必备仪器,该仪器为 。某同学认为即使添加了该仪器上述装置验证产生了乙烯不够严密,仍须在酸性高锰酸钾溶液之前添加洗气装置,其理由为 。
某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。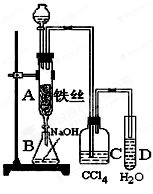
(1)写出A中反应的化学方程式:
(2)观察到A中的现象是 _______________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关的化学方程式。
(4)C中盛放CCl4的作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是。
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有下列哪些试剂的洗气瓶()
| A.澄清石灰水,浓H2SO4 | B.酸性KMnO4,浓H2SO4 |
| C.溴水,浓H2SO4 | D.浓H2SO4,溴水 |
【化学——化学与技术】
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用如图所示的工艺流程生产硫酸。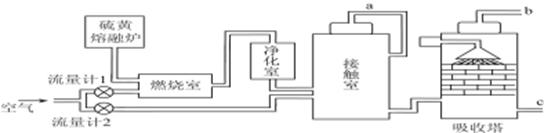
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是__________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________。(空气中氧气的体积分数按0.2计),该尾气的处理方法是____________________________________________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式__________________________________________、______________________________、___________________________________________。