已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,针对此过程的下列叙述正确的是( )
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42—)较原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42—)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42—)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42—)较原来的大 |
下列事实不能用勒夏特列原理解释的是
| A.在硫化氢水溶液中加入碱有利于S2-的生成 |
| B.加入催化剂有利于氨的氧化反应 |
| C.高压有利于合成氨反应 |
| D.向新制氯水中加入碳酸钙有利于次氯酸浓度增大 |
已知:H2O(g)═H2O(l)△H1=﹣Q1kJ•mol﹣1(Q1>0)
C2H5OH(g)═C2H5OH(l)△H2=﹣Q2kJ•mol﹣1(Q2>0)
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=﹣Q3kJ•mol﹣1(Q3>0)
依据盖斯定律,若使23g液态乙醇完全燃烧并恢复至室温,则放出的热量为(单位:kJ)()
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.0.5Q1﹣1.5Q2+0.5Q3 | D.1.5Q1﹣0.5Q2+0.5Q3 |
镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd(OH)2+2Ni(OH)2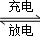 Cd+2NiO(OH)+2H2O;有关该电池的说法正确的是()
Cd+2NiO(OH)+2H2O;有关该电池的说法正确的是()
| A.放电时正极反应:NiO(OH)+e﹣+H2O═Ni(OH)2+OH﹣ |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH﹣向正极移动 |
下列关于热化学反应的描述中正确的是()
| A.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(﹣57.3)kJ/mol |
B.CO(g)的燃烧热是﹣283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+ O2(g)═CO2(g)△H=﹣283.0 kJ/mol O2(g)═CO2(g)△H=﹣283.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是()
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该电池的充电过程 |
| B.因部分电能转化为热能,电镀是通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后即对铁制品失去保护作用 |