(届南京市秦淮区第一学期期末试题)铁矿石冶炼成铁是一个复杂的过程。炼铁的原理是利用一氧化碳与氧化铁的反应,该化学方程式为 。
(1)某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产含铁98%的生铁的质量是多少?(请写出计算过程,结果精确到0.1t)
(2)某化学兴趣小组在实验室中模拟炼铁原理的实验,并对固体产物的成分进行探究。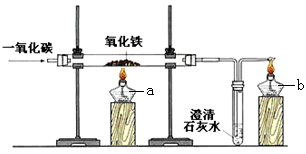
[设计实验] 用一氧化碳还原纯净的氧化铁粉末,实验装置如右图,酒精灯b的作用是 。
[进行实验]该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)。
②反应后玻璃管和内盛黑色固体的总质量m(冷却到室温称量)。
[分析与讨论]本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
[查阅资料]
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
③
| 物质 性质 |
四氧化三铁 |
氧化亚铁 |
氧化铁 |
铁粉 |
| 颜色 |
黑色 |
黑色 |
红色 |
黑色 |
| 能否被磁铁吸引 |
能 |
不能 |
不能 |
能 |
[进一步实验和得出结论]
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和 。
②该小组同学将黑色固体粉末投入硫酸铜溶液中,一段时间后无紫红色固体析出,则该黑色固体粉末为 。其实,进行如上图所示实验后,若测得反应后玻璃管和内盛黑色固体的总质量m为 g,也能得出这个结论。
[反思与评价]一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间。上图所示实验装置中,应作的一处修改是 。
人体缺乏维生素C(简写“VC”)就会患坏血病,哥伦布探险时的许多船员就因此而死亡。右图所示为某种“维生素C”说明书的一部分。请你回答:
(1)“VC”中含有种元素,相对分子质量为_______。
(2) 若正常成人每天对“VC”的最低需要量为60mg。当“VC”完全来自右图的“维生素C”药片,则每天至少服用____次;
尿素是一种肥效高、土壤适应性好的的常用氮肥,其化学式为CO(NH2)2。某化肥厂生产一批尿素,经测定其中氮元素的质量分数为43.5%,请列式计算并回答下列问题:(1)试通过计算说明该尿素样品是纯净物还是混合物?
(2)按规定,产品中含尿素的质量分数在95%以上为一等品,试根据计算判断该厂所生产的尿素能否按一等品出售?
(3分) 世博会上所使用的饭盒、胸卡、证件等都用可完全降解的“玉米塑料”制成,制作的第一步是将玉米发酵制得乳酸(C3H6O3)。试列式计算:
(1)乳酸的相对分子质量。
(2)多少克乳酸与88克二氧化碳中所含碳元素的质量相等?
(4分)莽草酸(化学式:C7H10O5)是制取抗“H1N1流感”药物“达菲”的原料。
请计算:(写出计算过程,并注意格式)
(1)莽草酸分子中C、H、O的质量比;
(2)莽草酸中氢元素的质量分数(精确到0.1%);
(3)174g莽草酸含氢元素的质量:
(4)对1岁以上的儿童推荐按照下列“体重一剂量表”服用“达菲”:
| 体重 |
小于等于15千克 |
15~23千克 |
23~40千克 |
大于40千克 |
| 每次用量 |
30mg |
45mg |
60mg |
60mg |
假如患病儿童的体重是35千克,在治疗过程中,需每天服用“达菲”胶囊(每颗胶囊含“达菲”60mg)2次,一个疗程5天,那么该患儿一个疗程共需服用多少颗?
实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5 g,加入1g MnO2,完全反应后称得剩余物的质量为41.9 g。计算:
(1)反应中放出氧气的质量。
(2)实验中参加反应的过氧化氢的质量。