短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是( )
| A.原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B.元素Z、W的简单离子的电子层结构不同 |
| C.元素Y的简单气态氢化物的热稳定性比Z的强 |
| D.只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔) =4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。下列有关说法正确的是d
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是d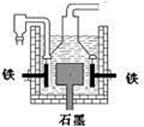
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑ |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
用铜片、银片、Cu(NO3) 2溶液、AgNO3溶液、导线和盐桥(装有琼脂—KNO3的U型管)构成一个原电池(如图)。以下有关该原电池的叙述正确的是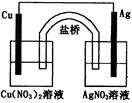
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag+ + e- = Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
| A.当电池负极消耗amol气体时,电解池阴极有amol气体生成 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C.电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D.反应后,电池中c(KOH)不变;电解池中溶液pH变大 |
某同学按下图所示的装置进行试验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处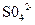 从右向左移动。下列分析正确的是
从右向左移动。下列分析正确的是
A.B的电极反应:
B.在ASO4溶液中,(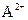 )浓度减小
)浓度减小
C. 电极上有
电极上有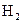 产生,发生还原反
产生,发生还原反
应
D.反应初期, 电极周围出现白色胶状沉淀
电极周围出现白色胶状沉淀
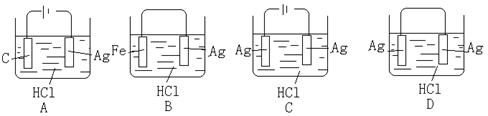
.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是: