在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )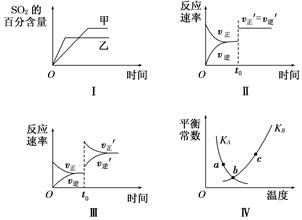
| A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是
| A.电池的负极反应为:Mg – 2e-= Mg2+ |
| B.电池工作时,H+向负极移动 |
| C.电池工作一段时间后,溶液的pH增大 |
| D.电池总反应是:Mg + H2O2 + 2H+= Mg2++ 2H2O |
下列有关工业生产的叙述正确的是
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
已知反应2CO(g)==2C(s)+O2(g) 的 为正值,
为正值, 为负值。设
为负值。设 和
和 不随温度而变,下列说法中正确的是
不随温度而变,下列说法中正确的是
| A.低温下能自发进行 | B.任何温度下都不能自发进行 |
| C.低温下不能自发进行,高温下能自发进行 | D.高温下能自发进行 |
已知下列热化学方程式:Zn(s) +  O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +  O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
| A.-260.4 kJ/mol | B.-254.6 kJ/mol | C.-438.9 kJ/mol | D.-441.8 kJ/mol |
下列叙述正确的是()
| A.pH=3的醋酸溶液,稀释至10倍后pH =4 |
| B.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) <c(CH3COO—) |