为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
| |
电池 |
电解池 |
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3 mol Pb |
生成2 mol Al2O3 |
| C |
正极:PbO2+4H++ 2e-=Pb2++2H2O |
阳极:2Al+3H2O- 6e-=Al2O3+6H+ |
| D |
 |
 |
下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是
| A.野火烧不尽,春风吹又生 |
| B.春蚕到死丝方尽,蜡炬成灰泪始干 |
| C.粉身碎骨浑不怕,要留清白在人间 |
| D.爆竹声中一岁除,春风送暖人屠苏 |
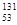 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中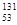 I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关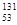 I的叙述中错误的是
I的叙述中错误的是
A.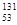 I的化学性质与 I的化学性质与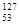 I相同 I相同 |
B.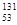 I的原子序数为53 I的原子序数为53 |
C.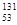 I的原子核外电子数为78 I的原子核外电子数为78 |
D.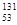 I的原子核内中子数多于质子数 I的原子核内中子数多于质子数 |
能在水溶液中大量共存的一组离子是
| A.H+、I―、NO3―、SiO32- |
| B.Ag+、Fe3+、Cl―、SO42― |
| C.K+、SO42-、Cu2+、NO3― |
| D.NH4+、OH-、Cl-、HCO3- |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是