在第二周期中,B、C、N、O四种元素的第一电离能由大到小的排列顺序正确的是( )
A.I1(N)>I1(C)>I1(O)>I1(B) B.I1(N)>I1(O)>I1(B)>I1(C)
C.I1(N)>I1(O)>I1(C)>I1(B) D.I1(O)>I1(N)>I1(C)>I1(B)
设NA为阿伏伽德罗常数的值,下列叙述正确的是()
| A.1 molCl2与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D.标况下,11.2 L HF所含的分子数目为0.5NA |
在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是()
A. mol mol |
B.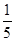 mol mol |
C.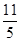 mol mol |
D.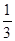 mol mol |
已知:Cu+2Fe3+=Cu2++2Fe2+;Zn+2Fe3+=2Fe2++Zn2+。现将等物质的量的CuSO4、FeCl3和Zn于水中充分反应,所得混合物中除了SO42—、Cl—外,还含有()
| A.Zn2+、Fe3+、Cu | B.Cu2+、Fe3+、Zn |
| C.Zn2+、Cu2+、Fe2+、Fe | D.Zn2+、Fe2+、Cu2+、Cu |
已知298K时,2SO2(g)+O2(g)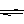 2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是()
2SO3(g);△H=-197KJ/mol。在相同的温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量Q2。则下列关系式正确的是()
| A.Q1=Q2=197KJ | B.Q1<Q2<197KJ | C.Q2<Q1<197KJ | D.Q1=Q2<197KJ |
向盛有一定量的Ba(OH)2的溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示),近似地用如下图曲线表示,应为( )