下列各组离子在指定溶液中一定能大量共存的是( )
| A.能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3—、Cl- |
| B.由水电离出的c(H+)=1×10-11 mol·L-1的溶液:Na+、Mg2+、Cl-、NO3— |
| C.0.2 mol·L-1的NaNO3溶液:H+、Fe2+、SO42—、Cl- |
| D.与Fe反应生成H2的溶液:NH4+、K+、SO42—、CO32— |
溶液中的反应:X+Y 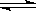 2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如右图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如右图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是 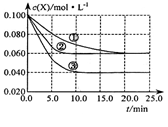
| A.前5min实验③的平均反应速率最快 | B.条件②的反应最先达到平衡 |
| C.②与①比较可能是压强更大 | D.该反应的正反应是吸热反应 |
某溶液中只存在OH-、H+、Cl-、NH4+ 四种离子,其离子浓度可能有如下关系。下列说法正确的是
①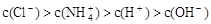 ②
②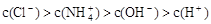
③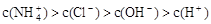 ④
④
| A.若①正确,则溶液中溶质一定为NH4Cl |
| B.溶质不同时,上述四种关系式均可能成立 |
| C.若④正确,且混合前盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH-) |
D.若③正确,则溶液中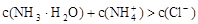 |
下列有关叙述正确的是
| A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)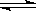 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
室温时,0.1 mol·L-1的HA 溶液的pH=3,向该溶液中逐滴加入NaOH,在滴加过程中,有关叙述正确的是
| A.原HA溶液中,c(H+)=c(OH-)+c(A-) |
| B.当滴入少量的NaOH,促进了HA的电离,溶液的pH降低 |
| C.当恰好完全中和时,溶液呈中性 |
| D.当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) |
关于下列各图的说法,正确的是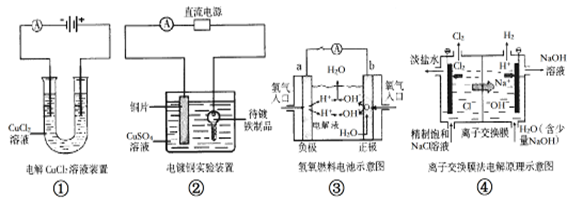
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |