下列有关物质的性质或结构的说法正确的是( )
| A.第二周期元素最高价与其原子最外层电子数相等 |
| B.Na的原子半径比Cl的大,但Na+的半径比Cl-的小 |
| C.Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱 |
| D.Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4 |
下图所示与对应叙述相符的是
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收氨气,且能够防止倒吸 |
| C.以NH4Cl和熟石灰为原料,装置③可用于制备少量NH3 |
| D.装置④可用于制取并收集干燥的O2 |
根据下列化学实验事实得出的结论一定正确的是
| A.向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解。结论:该溶液中含有SO42- |
| B.向某无色溶液中加入足量盐酸,产生能使澄清石灰水变浑浊的气体。结论:该溶液中含有CO32-或HCO3- |
| C.向1 mL浓度均为0.05 mol/L的NaCl、NaI混合溶液中滴加2滴0.01 mol /L的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI) |
| D.向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝。结论:该溶液中有NH4+ |
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是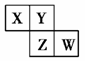
| A.四种元素的单质中,Z的熔沸点最高 |
| B.最高价氧化物对应水化物的酸性W比Z弱 |
| C.Y的气态氢化物的稳定性较Z的弱 |
| D.原子半径:W>Z>Y>X |
反应A+B →C分两步进行:①A+B→X,②X →C,反应过程中能量变化如图所示,E1表示反应A+ B→X的活化能。下列有关叙述正确的是
| A.E2表示反应X→C的活化能 |
| B.X是反应A十B→C的催化剂 |
| C.反应A十B→C的△H<0 |
| D.加入催化剂可改变反应A十B→C的焓变 |