标准状况下,某气态烷烃和烯烃的混合气体2.24L,完全燃烧后生成4.05g水和6.6gCO2,该烃的组成为
| A.CH4、C2H4 | B.C2H6、C2H4 | C.CH4、C3H6 | D.C2H6、C3H6 |
已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br + 2Na →CH3CH2CH2CH3 +2NaBr;应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
| A.CH3Br | B.CH2BrCH2CH2CH2CH2Br | C.CH2BrCH2Br | D.CH3CH2CH2CH2Br |
不饱和度(Ω)是衡量有机物分子氢原子饱和程度的尺度,与烷烃及饱和醇相比,分子中每少2个H原子,就有1个Ω,如乙烯、乙醛、苯的不饱和度依次为1、1、4。已知樟脑(C10H16O)的结构如右图,下列4式中与樟脑不属于同分异构体的是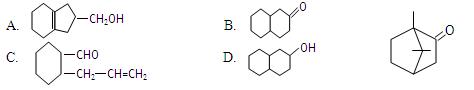
下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是
| A.甲苯反应生成三硝基甲苯 | B.甲苯能使酸性高锰酸钾溶液褪色 |
| C.甲苯燃烧产生带浓烟的火焰 | D.1 mol甲苯与3 molH2发生加成反应 |
据报道:2002年10月26日俄罗斯特种部队在解救人质时使用了一种麻醉作用比吗啡强100倍的氟烷,已知氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有
| A.1种 | B.2种 |
C.3种 | D.4种 |