下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC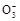 )+c(H+)>c(C )+c(H+)>c(C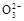 ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S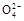 )>c(N )>c(N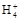 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC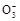 )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
下列说法错误的是( )
| A.原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 |
| C.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
依据元素周期表及元素周期律,下列推断正确的是( )
| A.同周期主族元素的原子形成的简单离子电子层结构相同 |
| B.C比Si的原子半径小,CH4的稳定性比SiH4弱 |
| C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 |
| D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 |
下列与有机物的结构、性质相关的叙述错误的是( )
| A.分子式为C5H12的烃可能有三种结构 |
| B.乙醇分子中含有羟基,可以和金属Na反应生成H2 |
| C.苯不能使Br2的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中相似的碳碳双键 |
| D.淀粉、蛋白质、油脂、葡萄糖在一定条件下均能发生水解反应 |
某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列有关该物质的说法不正确的是( )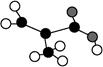
A.该物质的分子式为C4H6O2
B.该物质能发生加成反应、取代反应和氧化反应
C.该物质的最简单的同系物的结构简式为CH2 CHCOOH
CHCOOH
D.该物质是石油分馏的一种产物
下列除去杂质(括号内为杂质)的方法正确的是( )
①乙烷(乙烯)光照条件下通入Cl2,气液分离
②乙酸乙酯(乙酸)用饱和碳酸氢钠溶液洗涤、分液
③苯(乙酸)用氢氧化钠溶液洗涤、分液
④乙醇(乙酸)加足量生石灰,蒸馏
| A.①②③ | B.②③④ | C.①③④ | D.①②④ |