在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+。已知:AgSCN (白色s)  Ag+ + SCN-,Ksp="1.0" ×10-12 ;Fe3+ + SCN-
Ag+ + SCN-,Ksp="1.0" ×10-12 ;Fe3+ + SCN-  FeSCN2+ (红色), K=138
FeSCN2+ (红色), K=138
下列说法不正确的是
| A.边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 |
| B.当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 |
| C.上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ |
| D.滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
[2012·龙岩一模] 下列说法正确的是()
| A.石油的分馏和煤的干馏都是物理变化 |
| B.甲烷、苯、乙酸乙酯都可以发生取代反应 |
| C.油脂、蛋白质和纤维素都是高分子化合物 |
| D.在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性 |
[2012·福建卷]下列做法不正确的是()
| A.易燃试剂与强氧化性试剂分开放置并远离火源 |
| B.用湿润的红色石蕊试纸检验氨气 |
| C.在50 mL量筒中配制0.1000 mol·L-1碳酸钠溶液 |
| D.金属钠着火时,用细沙覆盖灭火 |
[2012·商丘三模] 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是()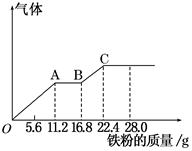
| A.混合酸中NO物质的量为0.4mol |
| B.OA段产生的是NO,AB段的反应为:Fe+2Fe3+→3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为5 mol·L-1 |
[2012·江西省重点中学协作体高三第二次联考] X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是()
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
[2012·广元三模]一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
①CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
下列选项正确的是()
| A.CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ·mol-1 |
| B.CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(l)ΔH3>ΔH1 |
| C.若用0.2mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6mol |