下列离子方程式书写正确的是
| A.澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| B.明矾溶液中滴加Ba(OH)2溶液至SO42–恰好完全沉淀:Al3++Ba2++ SO42–+3OH–=BaSO4↓+Al(OH)3↓ |
| C.200 mL 2 mol·L–1的FeBr2溶液中通入11.2 L标准状况下的氯气:4 Fe2++6Br–+5Cl2=4Fe3++3Br2+ 10Cl– |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO–+2Fe(OH)3=2FeO42–+3Cl–+H2O+4H+ |
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)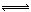 I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
下列实验设计能够成功的是
| 实验目的 |
实验步骤及现象 |
|
| A |
检验亚硫酸钠试样是否变质 |
 |
| B |
检验某盐是否为铵盐 |
 |
| C |
证明酸性条件H2O2氧化性比I2强 |
 |
| D |
除去氯化钠晶体中少量硝酸钾 |
 |
设NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.标准状况下,11.2L Cl2和H2混合气体原子数为2NA |
| B.常温下,pH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C.在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA |
| D.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
下列说法正确的是
| A.SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B.浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C.用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D.明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
下列说法正确的是
| A.CH3CH2CH2CH3的二氯取代产物只有5种结构 |
| B.油脂的种类很多,但它们水解后都有一相同产物 |
| C.乙烯、苯、纤维素均属于烃类化合物 |
| D.苯和乙烯都能使溴水层褪色,均与溴水发生加成反应 |