已知A、B、C、D之间的转化关系如图所示。下列说法正确的是
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D在常温下一定呈液态
常温下,将0.02 mol·L-1的Ba(OH)2溶液100mL和0.02 mol·L-1NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液
| A.pH=12 | B.溶质的物质的量浓度=0.02 mol·L-1 |
| C.pH=2 | D.由水电离的产生的c(H+)=1.0×10-2 mol·L-1 |
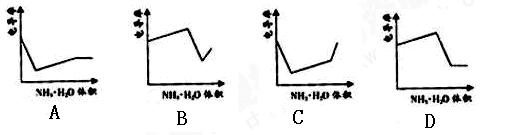
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是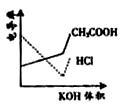
下列说法正确的是
| A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8 |
| B.给稀醋酸溶液适当加热,溶液pH值增大 |
| C.pH=1的盐酸中c(H+)是pH=3的盐酸的100倍 |
| D.在Na2CO3溶液中,C(Na+) :C(CO32-)=2∶1 |
降低下列溶液的pH,而难溶电解质的溶解度保持不变的是
| A.Al(OH)3 | B.PbCl2 | C.Ag3PO4 | D.ZnCO3 |
下列溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| B.室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液: c(Na+)=c(SO42-)>c(NH4+).>c(H+)>c(OH-) |
| C.Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合: |
c(CH3COOH)+c(CH3COO-)=0.2mol/L