海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案: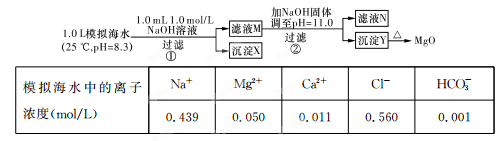
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。已知:KSp(CaCO3)=4.96×10-9;KSp(MgCO3)=6.82×10-6;KSp[Ca(OH)2]=4.68×10-6;KSp[Mg(OH)2]="5.61×10" -12。
下列说法不正确的是
| A.沉淀物X为CaCO3 |
| B.滤液M中存在Mg2+和Ca2+ |
| C.滤液N中存在Mg2+、Ca2+ |
| D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y只有Mg(OH)2 |
下列实验误差分析错误的是
| A.用容量瓶配制溶液时,定容时仰视刻度线,所配溶液浓度偏小 |
| B.用润湿的pH试纸测溶液的pH,所测pH不一定有误差 |
| C.测定中和反应的反应热时,将碱分多次倒入酸中,所测△H偏小 |
| D.酸碱中和滴定时,滴定前盛装标准液的滴定管内有气泡,终点读数时气泡消失,所测结果偏大 |
下列有关物质类别的判断依据,正确的是
| A.胶体:能否产生丁达尔现象 | B.离子化合物:是否含有离子键 |
| C.电解质:水溶液是否导电 | D.原子晶体:组成微粒是否为原子 |
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,可以由反应Al2O3+C+N2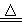 2AlON+CO合成,下列有关说法正确的是
2AlON+CO合成,下列有关说法正确的是
| A.氮氧化铝中氮的化合价是-3 |
| B.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| C.反应中每生成5.7g AlON 同时生成1.12 L CO |
| D.反应中氧化产物和还原产物的物质的量之比是2:1 |
设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.1mol·L-1NaCl溶液含有NA个Na+ |
| B.1.0 L 浓度为18mol·L-1H2SO4溶液与足量的铜片加热条件下反应,被还原的H2SO4的分子数为9NA |
| C.在酸性条件下,1molFe2+ 与足量的H2O2溶液反应,转移2 NA个电子 |
| D.1 mol Na 与足量O2在一定条件下反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
下列叙述错误的是
| A |
B |
C |
D |
 |
 |
  |
 |
| 闪电时会发生反应: N2 + O2  2NO 2NO |
利用丁达尔效应证明烧杯中的分散系是胶体 |
蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 |
加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |