家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行分析:
(1)该同学准备了下列实验用品:20% NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一个实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一
回答:
①若不是原电池,请说明原因: (如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是: 。
(3)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理: 。
生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2+2H2O+
CO2+2H2O+
4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
小苏打、胃舒、平达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5
,2片小苏打片和胃酸完全中和,被中和的
是
。
(2)胃舒平每片含0.245
。中和胃酸时,6片小苏打片相当于胃舒平片。
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01
,加入2.0
盐酸使其溶解,当加入盐酸42.5
时,开始产生
,加入盐酸至45.0
时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74 ,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
北京奥运会"祥云"火炬燃料是丙烷
,亚特兰大奥运会火炬燃料是丙烯
。
(1)丙烷脱氢可得丙烯。
已知:
 +
≡
+
;△
="156.6"
-1
+
≡
+
;△
="156.6"
-1
=
 +
=
;△
="32.4"
-1
+
=
;△
="32.4"
-1
则相同条件下,反应
 =
+
的△
=
-1
=
+
的△
=
-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入
和
,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为;放电时,
2-移向电池的(填"正"或"负")极。
(3)碳氢化合物完全燃烧生成
和
。常温常压下,空气中的
溶于水,达到平衡时,溶液的
=5.60,
(
)=1.5×10-5
-1。若忽略水的电离及
的第二级电离,则
 - +
+的平衡常数
=。(已知:10-5.60=2.5×10-6)
- +
+的平衡常数
=。(已知:10-5.60=2.5×10-6)
(4)常温下,则溶液
(
)
(
-)(填">"、"="或"<"),原因是(用离子方程式和必要的文字说明)。
红磷
和
发生反应生成
和
。反应过程和能量关系如图所示(图中的
表示生成1
产物的数据)。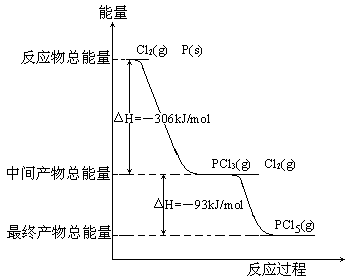
根据上图回答下列问题:
(1)
和
反应生成
的热化学方程式。
(2)
分解成
和
的热化学方程式,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80
,反应达到平衡时
还剩0.60
,其分解率
等于;若反应温度由
升高到
,平衡时
的分解率为
,
(填"大于"、"小于"或"等于")。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物
,然后降温,再和
反应生成
。原因是。
(4)
和
分两步反应生成1
的
=,
和
一步反应生成1
的
(填"大于"、"小于"或"等于")。
(5)
与足量水充分反应,最终生成两种酸,其化学方程式是。
取化学式为
的黄色粉末状化合物进行如下实验。将
和足量的碳粉充分混合物,平铺在反应管
中,在
瓶中盛足量澄清石灰水。按图连接仪器。
实验开始时缓缓通入氮气,过一段时间后,加热反应管
,观察到管内发生剧烈反应,并有熔融物生成,同时,
瓶的溶液出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却,此时,管中的熔融物凝固城银白色金属。根据以上叙述回答:
(1)元素
是;
(2)停止加热前是否需要先断开
和
的连接处?为什么?;
(3)反应管
中发生的所有反应的化学方程式是;
(4)本实验的围棋是否需处理?如需处理,请回答如何处理;如不需处理,请说明理由。。