某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 |
应该观察到的现象 |
| |
|
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
| 操作 |
现象 |
| 向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 |
静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇分子中官能团的名称是________________。
(2)试管a中加入几块碎瓷片的目的是_________。
(3)试管a中发生反应的化学方程式为_____________________________,反应类型是____________________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
下图是苯和溴的取代反应的实验装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量的铁屑粉。填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中发生反应的化学方程式(有机物写结构简式):,反应类型:属于________反应;
(2)试管C中苯的作用是。反应开始后,观察D和E两试管,看到的现象是DE。
(3)反应2min~3min后,在B中的氢氧化钠溶液里可观察到的现象是。
(4)在上述整套装置中,具有防倒吸作用的仪器有(填字母)。
(5)苯还可以与氢气反应,写出反应方程式,反应类型:属于_______反应。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: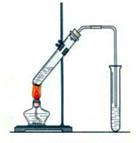
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先加再加和。
(2)浓硫酸的作用是:①;②。
(3)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(4)饱和碳酸钠溶液的主要作用是①②
③。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(8)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是_________________。
(10分)下图是化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。 ,
,
(1)B中逸出的主要气体是____________________(填名称);
(2)D瓶的作用是_____________________________;
(3)E管的作用是_________________________;
(4)F管口点燃的气体是___________________(填化学式);
(5)A瓶中无水 变蓝的原因是________________________。
变蓝的原因是________________________。
(6)由A中发生的反应事实可推断出的结论是:________________________
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是_____________________________;
(3)烧杯B的作用是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、碳酸氢钠粉末。实验仪器任选。该方案为______________________________。