下列能够检验出KI中是否含有Br-的实验是( )
| A.加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B.加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C.加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D.加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
已知分子式为C12H12的物质A的结构简式为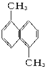 ,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有
,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有
| A.9种 | B.10种 | C.11种 | D.12种 |
为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
| A.甲 | B.乙 | C.丙 | D.上述实验方案都不正确 |
由两种烃组成的混合气体2L与足量的氧气充分反应后生成CO2 5L、H2O 7L(所有体积都在120℃测定),则这两种混合气体的可能组成是
| A.C2H4、C3H8 | B.CH4、C5H8 |
| C.CH4、C4H8 | D.C2H6、C3H8 |
有A、B两种烃,含碳元素的质量分数相等,下列关于A和B的叙述正确的是
A. A和B一定是同分异构体
B. A和B不可能是同系物
C. A和B实验式一定相同
D. A和B各1 mol完全燃烧后生成的CO2的质量一定相等
用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为
| A.3种 | B.4种 | C.5种 | D.6种 |