以下进行性质比较的实验设计,不合理的是( )
| A.比较Cu、Fe2+的还原性:Cu加入FeCl3溶液中 |
| B.比较氯、溴非金属性:氯气通入溴化钠溶液中 |
| C.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4 mol·L-1 NaOH溶液中 |
| D.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸 |
下列废物处理方法中正确的是( )。
| A.化学实验中产生的二氧化硫废气可用浓硫酸吸收 |
| B.化学实验中产生的二氧化氮废气可用水直接吸收 |
| C.用黄铁矿作原料生产硫酸的过程中产生的废渣可用于提取燃料 |
| D.用黄铁矿作原料生产硫酸的过程中产生的废气可用于提取漂白剂 |
根据平衡移动的原理,能提高氨的产量的措施是( )。
| A.及时把生成的氨液化分离 |
| B.升温有利于氨的生成 |
| C.使用催化剂促进氮的转化 |
| D.增大压强,不利于氨的生成 |
如图所示,电解含有少量酚酞的饱和食盐水。下列有关说法正确的是( )。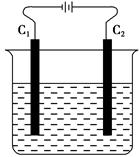
| A.C1称为阳极,电解时,该极附近溶液先变红色 |
| B.C2称为正极,电解时,该极上Cl-被还原为氯气 |
| C.电解时若两极产生的物质在溶液中发生作用,整个电解反应为NaCl+H2O=NaClO+H2↑ |
| D.电解时,电流从电源负极经导线至C1经电解质溶液至C2经导线至电源正极 |
下列金属冶炼的反应原理,错误的是( )。
A.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ |
B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe3O4+4CO 3Fe+4CO2 3Fe+4CO2 |
D.2HgO 2Hg+O2↑ 2Hg+O2↑ |
在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是( )。
| A.硫铁矿煅烧前要将矿粒粉碎,因为大块的硫铁矿不能燃烧 |
| B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 |
| C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率 |
| D.SO3用质量分数为98%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全 |