利用常温下氨与氯气能发生置换反应的性质,氯碱工业生产中用来检查氯气是否泄漏,其模拟装置如图所示。下列有关说法中错误的是( )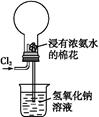
| A.烧瓶中立即出现白烟 |
| B.烧瓶中立即出现红棕色气体 |
| C.烧瓶中发生的反应表明常温下氨气有还原性 |
| D.烧瓶中还发生了化合反应 |
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定的基准物质,在1 L 0.1 mol/L的该盐溶液中,下列有关比较正确的是
| A.c(NH4+)+c(NH3·H2O) =" 0.1" mol/L |
| B.2c(Fe2+)+c(NH4+) = 2c(SO42-) |
| C.c(NH4+)∶c(Fe2+)∶c(SO42-) = 2∶1∶2 |
| D.c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.无色溶液中:K+、Fe3+、SO42-、H+ |
| C.c (H+)/c (OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
为了得到比较纯净的物质,使用的方法恰当的是
| A.向Na2CO3饱和溶液中,通入过量的CO2后,加热、蒸发得到NaOH晶体 |
| B.向Fe2(SO4)3溶液加入足量NaOH溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
| C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 |
| D.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
用0.1mol/L的NaOH溶液滴定100mL0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的pH范围是
| A.4.3~9.7 | B.3.3~10.7 | C.6.9~7.1 | D.6~8 |
20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,若要使溶液的pH和c(S2-)减小,可采取的措施是
| A.通入适量的H2S气体 | B.加入少量的氢氧化钠固体 |
| C.加入适量的CuSO4固体 | D.加入适量水 |