关于下列各实验装置的叙述中,不正确的是( )
| A.装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| B.实验②放置一段时间后,小试管内有晶体析出 |
| C.实验③振荡后静置,上层溶液颜色变浅 |
| D.实验④不能用来检查装置的气密性 |
下列关于有机物性质的说法正确的是
| A.乙烯和甲烷都可以与氯气反应 | B.乙烯和聚乙烯都能使溴水褪色 |
| C.乙烯和苯都能使酸性高锰酸钾溶液褪色 | D.乙酸能与钠产生氢气,而乙醇不可以 |
某有机物A用质谱仪测定如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为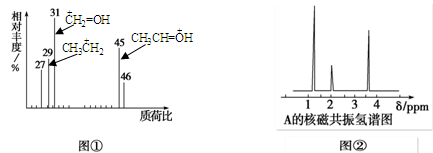
| A.HCOOH | B.CH3CHO | C.CH3CH2OH | D.CH3CH2CH2COOH |
下列物质中最简式相同,但既不是同系物,也不是同分异构体的是
A. 和 和 |
B.乙炔和苯 |
C.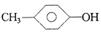 和 和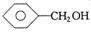 |
D.葡萄糖与麦芽糖 |
下图是一些常见有机物的转化关系,以下有关反应的说法不正确的是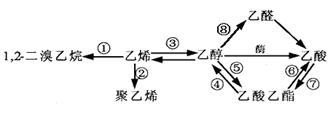
| A.反应①是加成反应 |
| B.反应②是加聚反应 |
| C.反应③是消去反应 |
| D.反应④⑤⑥是取代反应 |
用括号中的试剂除去各组中的杂质,不正确的是
| A.苯中的甲苯(溴水) | B.乙醇中的水(新制CaO) |
| C.甲烷中的乙烯(溴水) | D.乙酸乙酯中的乙酸(饱和Na2CO3溶液) |