Ⅰ.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流等等。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是 (可以多选)
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体
Ⅱ.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水,有刺激性气味,对人的呼吸系统有损伤,可与碱发生作用。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: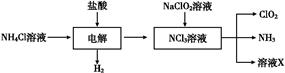
(1)写出电解时发生反应的化学方程式 ;
(2)除去ClO2中的NH3可选用的试剂是 (填序号);
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL足量硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收(假设吸收完全);将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2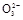
 2I-+S4
2I-+S4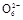 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。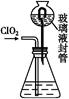
①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)。
用
酸性溶液脱除
后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1
溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| I |
x≥a |
电极附近出现黄色,有气泡产生 |
有 、有 |
| II |
a>x≥b |
电极附近出现黄色,无气泡产生 |
有
、无
|
| III |
b>x>0 |
无明显变化 |
无
、无
|
(1)用KSCN溶液检验出
的现象是。
(2)I中,
产生的原因可能是
在阳极放电,生成的
将
氧化。写出有关反应的方程式。
(3)由II推测,
产生的原因还可能是
在阳极放电,原因是
具有性。
(4)II中虽未检测出
,但
在阳极是否放电仍需进一步验证。电解pH=1的
溶液做对照实验,记录如下:
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| IV |
a>x≥c |
无明显变化 |
有
|
| V |
c>x≥b |
无明显变化 |
无
|
①NaCl溶液的浓度是mol/L。
②IV中检测Cl2的实验方法:。
③与II对比,得出的结论(写出两点):。
NH3经一系列反应可以得到HNO3,如下图所示。
(1)I中,
和
在催化剂作用下反应,其化学方程式是。
(2)II中,
。在其他条件相同时,分别测得
的平衡转化率在不同压强(
、
)下温度变化的曲线(如右图)。
①比较
、
的大小关系:。
②随温度升高,该反应平衡常数变化的趋势是。
(3)III中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:
下列能量变化示意图中,正确的是(选填字母)。
②
与
、
化合的化学方程式是。
(4)IV中,电解
制备
,其工作原理如右图所示,为使电解产物全部转化为
,需补充物质
,
是,说明理由:。
顺丁橡胶、制备醇酸树脂的原料
以及杀菌剂
的合成路线如下:

(1)
的名称是;
(2)反应I的反应类型是(选填字母);
a.加聚反应 b.缩聚反应
(3)顺式聚合物
的结构式是(选填字母);
(4)AP
的相对分子质量为108.
①反应II的化学方程式是
②1
完全转化为
所消耗的
的质量是
。
(5)反应III的化学方程式是。
(6)
的某些同分异构体在相同反应条件下也能生成
和
,写出其中一种同分异构体的结构简式。
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
碳粉/ | 铁粉/ | 醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
36.0 |
|
| ③ |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。
时,容器中压强明显小于起始压强,其原因是铁发生了腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了("氧化"或"还原")反应,其电极反应式是。
(3)该小组对图2中0~
时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有
的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
是锂离子电池中广泛应用的电解质。某工厂用
、
为原料,低温反应制备
,其流程如下:
已知:
的沸点是-85.0 ℃,
的沸点是19.5 ℃。
(1)第①步反应中无水
的作用是、。反应设备不能用玻璃材质的原因是(用化学方程式表示)。无水
有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中
极易水解,其产物为两种酸,写出
水解的化学方程式:。
(3)第④步分离采用的方法是;第⑤步分离尾气中HF、HCl采用的方法是。
(4)
产品中通常混有少量
。取样品
。测得
的物质的量为
,则该样品中
的物质的量为
(用含有
、
的代数式表示)。