某化学兴趣小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案一:铜铝混合物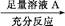 测定生成气体的体积
测定生成气体的体积
方案二:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
| A.溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B.若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| C.方案一可能产生氢气,方案二可能剩余铜 |
| D.实验室中方案二更便于实施 |
铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混合、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1 mg。那么一个铅笔字含有的碳原子数约为( )
| A.2.5×1019个 | B.2.5×1022个 | C.5×1019个 | D.5×1022个 |
相同质量的CO2和N2O相比较,不一定相同的是( )
| A.分子数 | B.原子数 | C.体积 | D.电子数 |
在反应X+2YR+2M中,已知R和M的摩尔质量之比为22∶9,当1.6 g X与Y完全反应后,生成4.4 g R,则在此反应中Y和M的质量之比为( )
| A.16∶9 | B.23∶9 |
| C.32∶9 | D.46∶9 |
等物质的量的SO2和SO3相比较,下列结论错误的是( )
| A.它们的分子数目之比为1∶1 |
| B.它们的质量之比为1∶1 |
| C.它们的氧原子数目之比为2∶3 |
| D.它们所含原子数目之比为3∶4 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A.10 g甲烷所含有的电子数目为10NA |
| B.常温常压下,4 g氦气所含有的中子数目为4NA |
| C.标准状况下,22.4 L单质溴所含有的原子数目为2NA |
| D.电解食盐水若产生2 g氢气,则转移的电子数目为2NA |