某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(NH4+)随反应进行逐渐减小。下列判断错误的是
| A.反应的氧化剂是ClO- |
| B.消耗l mol还原剂,转移电子3 mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
下列与化学反应能量变化相关的叙述正确的是
| A.石油、沼气、天然气、植物油都属于可再生能源 |
| B.水蒸气变为液态水时放出的能量就是该变化的反应热 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同 |
在密闭容中发生下列反应aA(g)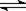 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
25℃,101kPa时,使1.0 g钠与足量氯气反应,生成氯化钠晶体并放出17.87kJ的热量,生成1 mo NaCl的反应热为
| A.17.87kJ | B.—17.87kJ/mol | C.411 kJ/mol | D.—411 kJ/mol |
下列说法中正确的是
| A.原电池是把电能转化为化学能的装置 |
| B.原电池中电子流入的一极是正极,发生还原反应 |
| C.铜锌原电池中电子由锌电极经过溶液到铜电极 |
| D.原电池中的阳离子向负极移动 |