根据物质的组成和性质将下列无机化合物进行了分类。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
氢化物 |
| 化学式 |
①H2SO4 ②______ |
③NaOH ④______ |
⑤Na2SO4 ⑥______ |
⑦SO2 ⑧Na2O |
⑨HCl ⑩_____ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的物质,将化学式分别填在表中②、④、⑥、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为________________________________________________________________________。
(3)将⑦通入③的溶液中,反应的离子方程式为_______________________________________。
(4)⑨极易溶于水并电离出氯离子,大多数含氯离子的盐溶于水后也能电离出氯离子。检验溶液中氯离子的方法是_____________________________________________。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。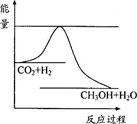
(1)关于该反应的下列说法中,正确的是_______。
| A.△H>0,△S>0; | B.△H>0,△S<0; |
| C.△H<0,△S<0; | D.△H<0,△S>0。 |
(2)该图中能量的最高点和最低点之间的差值代表
(3)以CH4和H2O为原料,通过下列反应来制备甲醇。
① CH4(g)+H2O(g) ="=" CO(g)+3H2(g) △H=+206.0KJ/mol
② CO(g) + 2H2(g) ="=" CH3OH(g) △H=-129.0KJ/mol
CH4(g)和H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜玛拉雅山区是高发病地区。我国云南、河南等十余个省的山区的发病率也较高。为控制该病的发生,较为有效的方法是加碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾。据此回答下面问题。
(1)碘是合成下列哪种激素的主要原料之一
A、 胰岛素 B、 甲状腺激素 C、 生长激素 D、 糖尿病
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患
A、 甲状腺机能亢进 B、 佝偻病
C、 地方性甲状腺肿 D、 雄性激素减少
(3)可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾。反应的化学方程式为:5KI + KIO3 + 6HCl ="==" 6KCl + 3I2 +3H2O。此反应的氧化剂是 (填化学式),能观察到的明显现象是____________________。
(1)制造普通玻璃的主要原料是纯碱、石灰石和 。
(2)油脂被摄入人体后,在酶的作用下水解为 和甘油(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(3)发育出现障碍,患营养缺乏症,这主要是由于摄取________(填“蛋白质”、“脂肪”或“糖类”)不足引起的。下列食物中富含该物质的是 (填字母)。
| A.菠菜 | B.花生油 | C.瘦肉 | D.西瓜 |
下列常用物质: A 碳酸氢钠B 阿司匹林 C 葡萄糖 D 苯甲酸钠 E 柠檬黄请用字母填空:
具有解热镇痛疗效的是 ;可直接进入人体血液补充能量的是 ;可用作食品防腐剂的是 ;常用作食品着色剂的是 ;常用作治疗胃酸过多的抗酸剂的是 ,写出该抗酸药发挥功效时的化学方程式 。
防治环境污染,改善生态环境己成为全球的共识。
(1)垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有 (填字母)标志的垃圾筒内。
(2)工业废水需处理达标后才能排放。下列废水处理的方法合理的是 (填字母)。
a.用中和法除去废水中的酸 b.用混凝法除去废水中的重金属离子
c.用氯气除去废水中的悬浮物 d.用氧化还原法除油类、氰化物
(3)为了减少煤燃烧产生的SO2对大气造成的污染,可向煤中加入适量石灰石。石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,写出该反应的化学方程 。
(4)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 。