(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是 。
(2)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是 ,B可能是 。
(3)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是 L,质量是 g。
下列热化学方程式,正确的是()
| A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ  ·mol-1 ·mol-1 |
B.稀的强酸和稀的强碱溶液反应的热化学方程式均为: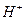 +OH-H2O(1); +OH-H2O(1);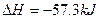 ·mol-1 ·mol-1 |
| C.在25℃、101 kPa时,1克H2完全燃烧生成H2O放出热量142.9kJ。则: 2H2O(1)2H2(g)+O2(g);△H= +571.6kJ·mol-1 |
| D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: |
N2(g)+3 H2(g) 2NH3(g)△H= -38.6kJ·mol-1
2NH3(g)△H= -38.6kJ·mol-1
已知反应mX(g)+nY(g)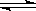 qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A.通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
用蒸馏水稀释1 mol/L醋酸时,始终保持增大趋势的是( )
| A.溶液中的c(CH3COO-) | B.溶液中的c(H+) |
| C.溶液中的c(CH3COOH) | D.溶液中的c(OH-) |
一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:
A(s)+2B(g) 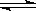 C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ( )
①混合气体的密度 ②容器内气体的压强
③混合气体的总物质的量 ④B的物质的量浓度
| A.①④ | B.②③ |
| C.②③④ | D.只有④ |
已知HCN(aq)与NaOH(aq)反应的 ;HCl(aq)与NaOH(aq)反应的
;HCl(aq)与NaOH(aq)反应的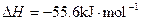 ,则HCN在水溶液中电离的
,则HCN在水溶液中电离的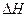 等于 ( )
等于 ( )
A.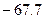  |
B.-43.5 |
C.+43.5 |
D.+67.7 |