下列离子方程式书写正确的是( )
| A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl24Fe2++6I-+5Cl2=4Fe3++3I2+10Cl- |
| C.向NaHCO3溶液中加入过量的澄清石灰水2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
| D.向明矾溶液中加入过量的氢氧化钡溶液Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
下列各组离子在水溶液中能大量共存的是
| A.Na+、Ba2+、Cl-、SO42- |
| B.Ca2+、HCO3-、C1-、K+ |
| C.Mg2+、Ag+、NO3-、Cl- |
| D.H+、Cl-、Na+、CO32- |
下列离子方程式中,不正确的是
A.稀硫酸中加入氧化铜: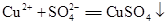 |
B.盐酸与澄清石灰水混合: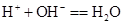 |
C.铁片插入稀硫酸中: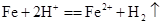 |
D.硫酸钠溶液和氯化钡溶液混合: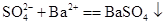 |
根据反应式:①2Fe3++2I-===2Fe2++I2;②Br2+2Fe2+===2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- |
| B.Fe2+、I-、Br- |
| C.Br-、I-、Fe2+ |
| D.I-、Fe2+、Br- |
下列萃取和分液结合进行的操作(用煤油为萃取剂从碘水中萃取碘)中,错误的是
| A.饱和碘水和煤油加入分液漏斗中后,塞上口部的塞子,且一手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来用力振荡; |
| B.静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通,以准备放出液体 |
| C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 |
| D.上层液体在分液漏斗中保存 |
下列反应中,属于氧化还原反应的是
| A.CaCO3+2HCl= CaCl2+CO2↑+H2º |
| B.CaO+H2O = Ca(OH)2 |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.CaCO3 CaO+CO2↑ CaO+CO2↑ |