下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是( )
| A.Na+、Ba2+、NO3-、CO32- |
| B.Ba2+、K+、Cl-、NO3- |
| C.Mg2+、NH4+、SO42-、Cl- |
| D.Fe2+、Na+、SO42-、NO3- |
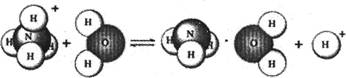
则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
A.存在NH3·H2O,其结构式为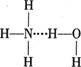 |
B.存在NH4+,其电子式为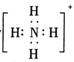 |
C.存在H3O+,其结构式为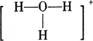 |
D.存在OH-,其电子式为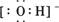 |
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水。 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+。 |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-。 |
| D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+。 |
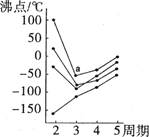
沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
| A.NH3 | B.H2S | C.SiH4 | D.HF |
| A.①④ | B.①③ | C.②④ | D.②③ |
| A.Na+、NH4+、SO42-、NO3- | B.Fe3+、Mg2+、Cl-、SO42- |
| C.Na+、K+、Cl-、SO42- | D.K+、Na+、A1O2-、MnO4- |