碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下: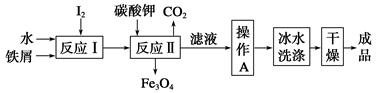
①反应Ⅰ生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21∶127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为____________________。
②操作A包括__________________;用冰水洗涤的目的是__________________。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是_____________________________
②若制得1 284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水________ kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为____________。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比________(选填“增大”、“减小”或“不变”)。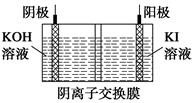
化合物A、D、F是中学化学中常见的物质,化合物B、C、E中含有两种相同的元素。这些化合物之间存在如下图的转化关系。其中A和B的反应是一种重要化工生产中的主要反应之一。
(1)在化合物A、C、F中含有相同的元素是________________。
(2)化合物C的化学式是________________。
(3)化合物C的水溶液和化合物D能否发生反应?,其理由是_________________________
______________________________________________________________________________。
GaAs(砷化镓)是仅次于硅的一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第ⅤA族。
(1)Ga和As的最外层电子数分别是:Ga________、As________。
(2)GaAs中Ga和As的化合价分别是:Ga________价、As________价。
(3)第ⅣA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为________。
2005年10月12日“神舟六号”载人飞船成功发射,是我国航天史上又一座新的里程碑,标志着我国在攀登世界科技高峰的征程上,又迈出了具有重大历史意义的一步。
(1)“神舟六号”飞船表面贴有特制的陶瓷片,其主要目的是_____________________。
(2)航天员采用的补氧剂有Na2O2、KO2两种选择,写出反应原理____________________。
(3)1 kg Na2O2与1 kg KO2分别与CO2反应,生成O2的体积(同温、同压)之比为_______。
(4)你认为选用_______作补氧剂更为合适,理由是:
框图中,A、B、C是单质,甲、乙、丙等是化合物;物质中所包含的元素都是短周期元素。
试完成下列问题:
(1)写出A、B、C的化学式:__________、__________、__________。
(2)写出甲、丙、己的化学式:__________、__________、__________。
(3)框图所列单质和化合物中,含有碳元素的是_________(写字母代号或汉字代号)。
铁氧体磁性材料在微波领域中有着重要作用,有一种铁、氧、钇三种元素组成的磁性材料,经测定该材料中钇、铁原子数之比为3∶5,氧的质量分数约为26.0%,则该材料的化学式为,钇、铁的化合价分别为。