为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验,可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
|
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入________,振荡 |
|
存在Fe2+ |
【实验结论】 Fe的氧化产物为Fe2+和Fe3+。
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
(2)装置B的作用是________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是________。
(4)【查阅资料】 Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有________。
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:

已知:FeTiO3+4H+=Fe2++TiO2++2H2O
草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为_______________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为(用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
反应②的方程式是___________。由TiCl4→Ti需要在Ar气中进行的理由是_____________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于℃即可。
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(10分)利用下图装置测定中和热的实验步骤如下: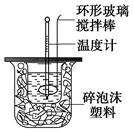
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ___________________________________________________________。
(2)倒入NaOH溶液的正确操作是________(从下列选出)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值(t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
____________________ |
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=___(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到下表中的数据:
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是。
(2)在操作正确的前提下,提高中和热测定准确性的关键是。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如果用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将(填“偏大”、“偏小”或“不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
下图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水硫酸铜粉末,并加入20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,由于浓H2SO4流入B中,则D中导管口有气泡产生.过几分钟后,无水硫酸铜粉末由无色变为蓝色.此时水浴加热后,发生化学反应,生成的气体从F处逸出,点燃气体,有绿色火焰.试回答: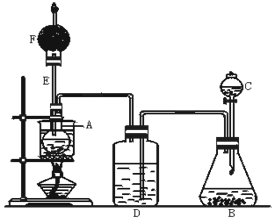
(1)B中逸出的气体主要________________.
(2)D瓶的作用是_______________.
(3)E管的作用是___________________,
(4)F管口点燃的气体是________________.
(5)A瓶中无水硫酸铜粉末变蓝的原因是____________.
(6)由A中发生的反应事实,可推断出的结论_________________.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ.用pH试纸检验,漂白液pH>7,饱和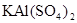 溶液pH<7。
溶液pH<7。
Ⅱ.取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ.另取10 mL,漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ.再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出反应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用下图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式__________。
③若打开分液漏斗活塞向烧瓶中加入饱和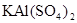 溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加
溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加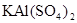 溶液反应的离子方程式是__________。
溶液反应的离子方程式是__________。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是__________。