3,5二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5二甲氧基苯酚的部分物理性质见下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20 ℃) /g·cm-3 |
溶解性 |
| 甲醇 |
64.7 |
— |
0.791 5 |
易溶于水 |
| 乙醚 |
34.5 |
— |
0.713 8 |
微溶于水 |
| 3,5二甲氧基苯酚 |
— |
33~36 |
— |
易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
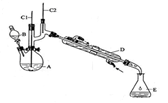
实验室合成环己酮的反应、装置示意图及有关数据如下: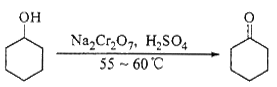
环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
| 物质 |
沸点(℃) |
密度(g·cm-3, 20℃) |
溶解性 |
| 环己醇 |
161.1(97.8) |
0.9624 |
能溶于水 |
| 环己酮 |
155.6(95) |
0.9478 |
微溶于水 |
| 饱和食盐水 |
108.0 |
1.3301 |
|
| 水 |
100.0 |
0.9982 |
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
①如何滴加酸性Na2Cr2O7溶液 ,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~ 156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、氯水。
(1)请完成下表:
| 操作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
____ |
存在Fe3+ |
Ⅱ.AgNO3的热稳定性
用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
(2)装置B的作用是____________________________________________________。
(3)经小组讨论并验证该无色气体为O2,其验证方法是__________________________________________________________。
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰAg;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是__①__(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有__②__。
已知AgNO3晶体加热分解生成两种单质和红棕色气体。用下列某些装置粗略测定混入了其他不分解也不参与反应的杂质的硝酸银的纯度,并进行有关实验(装置中必要的铁架台、铁夹、酒精灯等已略去),填写下列空白。
(1)写出AgNO3受热分解的化学方程式:_______________________________________________________________。
(2)测定AgNO3的纯度,可选用由A、B、C、D组成的装置,但其中不合理的是____________,该错误引起的后果是____________________________________________。
(3)B瓶中的空气对实验结果________(填“有”或“无”)影响,理由是____________________________________________________________________________。
(4)如果改进装置后,称取硝酸银试样4.00 g置于A中缓缓加热,待反应完全后,产生的气体通过B、C装置后,测得量筒中水的体积,并折算成标准状况下气体的体积为112 mL,则试样的纯度为________。
(5)如果加热Cu(NO3)2生成氧化铜,则加热分解所得气体应通入装置________(填“E”或“F”),其理由是__________________________________________________________。
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题: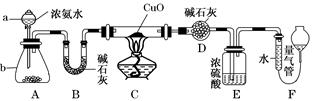
(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A还可制取的无色气体是________(填字母)
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式___________________________
________________________________________________________________________。
(4)E装置中浓硫酸的作用______________________________________________。
(5)读取气体体积前,应对装置F进行的操作:_______________________________________________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH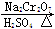 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.810 9 |
微溶 |
| 正丁醛 |
75.7 |
0.801 7 |
微溶 |
实验步骤如下:
将6.0 g Na2 Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________________________________。