某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 |
X |
Y |
Z |
W |
| 初始浓度/mol·L-1 |
0.5 |
0.6 |
0 |
0 |
| 平衡浓度/mol·L-1 |
0.1 |
0.1 |
0.4 |
0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
甲酸和乙醇发生酯化反应后生成的酯,其结构简式为()
| A.CH3COOCH2CH3 | B.HCOOCH2CH3 |
| C.CH3COOCH3 | D.HCOOCH3 |
分子组成为C9H12苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是( )
| A.该有机物不能发生加成反应,但能发生取代反应 |
| B.该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 |
| C.该有机物分子中的所有原子可能在同一平面上 |
| D.该有机物的一溴代物最多有6种同分异构体 |
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图所示: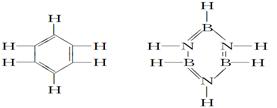
则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为 ( )
| A.2 | B.3 | C.4 | D.6 |
桶烯结构简式如图所示,有关说法不正确的是 ( )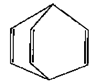
| A.桶烯分子中所有的原子在同一平面上 |
| B.桶烯在一定条件下能发生加聚反应 |
| C.桶烯与苯乙烯(C6H5CH==CH2)互为同分异构体 |
| D.桶烯中的一个氢原子被氯原子取代,所得产物只有两种 |
据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为:
HC≡C—C≡C—C≡C—C≡C—C≡N。对该物质判断正确的是 ( )
| A.晶体的硬度与金刚石相当 |
| B.能使酸性高锰酸钾溶液褪色 |
| C.不能发生加成反应 |
| D.可由乙炔和含氮化合物加聚制得 |