在25℃时,将酸HA与碱MOH等体积混合.
(1)若0.01mol/L的强酸HA与0.01mol/L强碱MOH混合,则所得溶液显 (填“酸性”、“中性”或“碱性”,下同)该反应的离子方程式为
(2)若PH=3的强酸HA与PH=11的弱碱MOH混合,则所得溶液显 ,理由是:
(3)若0.01mol/L的强酸HA与0.01mol/L弱碱MOH混合,则所得溶液显 ,解释这一现象的离子方程式是
运用比较方法是化学科学中研究物质性质的基本方法之一,请运用比较法解答题目。过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2 2Na2CO3+O2↑,Na2O2+CO
2Na2CO3+O2↑,Na2O2+CO Na2CO3。
Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:________、________。
现有A、B、C、D、E五种溶液,只知道它们的溶质是NaHCO3、Na2CO3、NaOH、HCl、Ca(HCO3)2。为了鉴别开来,各取少量进行如下实验:
(1)A与B混合无明显现象
(2)B与C(或D,或E)混合均有无色气体产生
(3)D与A(或E)混合均有白色沉淀产生
是根据以上现象,写出A~E各物质的名称:
A;B;C;D;E。
(1)用Al2(SO4)3制取Al(OH)3,常用氨水与Al2(SO4)3反应,而不用NaOH(aq),是什么原因? ________________________________________________________________。
(2)AlCl3与NaOH溶液反应,当Al3+与OH-的物质的量之比为________时沉淀最多,________时沉淀全部溶解,________时沉淀为最多时的一半。
(3)现代科学实验证明,溶液中不存在,应为[Al(OH)-4],是沿用旧的书写习惯。请写出Al2(SO4)3溶液与过量NaOH溶液反应的化学方程式(不能用偏铝酸盐表示):______________________。
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W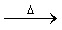 X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2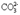 X+O2
X+O2
③Z+H2O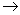 Y+O2↑
Y+O2↑
④X+Ca(OH)2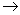 Y+CaCO3↓
Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W__________;X__________;Y__________;Z________。
(2)以上4个化学反应中,属于氧化还原反应的是________(填反应序号),反应中的氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:________________________________________________________;
②化学方程式:________________________________________________________。