下列叙述正确的是 ( )
A.1 mol N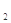 参加氧化还原反应时电子转移数为3×6.02×10 参加氧化还原反应时电子转移数为3×6.02×10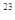 |
B.常温常压下,22.4L SO2含分子的个数为6.02×10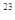 |
C.物质的量浓度为0.5 mol·L 的MgCl 的MgCl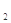 溶液,含有的Cl 溶液,含有的Cl 数为6.02×10 数为6.02×10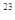 |
D.16g O2所含氧原子个数为6.02×10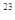 |
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是
| A.S2Cl2既作氧化剂又作还原剂 |
| B.H2O作还原剂 |
| C.每生成1 mol SO2转移4 mol电子 |
| D.氧化产物与还原产物物质的量之比为3∶1 |
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
①已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS
②已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2
③已知CO2分子是直线型结构,推测CS2分子也是直线型结构
④已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应
⑤已知NaOH是强电解质,其饱和溶液导电能力很强,Ca(OH)2也是强电解质,推测其饱和溶液导电能力也很强
| A.①③④ | B.①②⑤ | C.③④ | D.③④⑤ |
共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中只存在上述一种作用方式的是
| A.二氧化碳 | B.氢氧化钠固体 | C.NaCl晶体 | D.氯气 |
下列说法正确的是
| A.16O和18O原子的核外电子排布不相同 |
| B.含有离子键的化合物一定是离子化合物 |
| C.HF、HCl、HBr、HI的熔沸点逐渐升高 |
| D.干冰和二氧化硅熔化时所克服微粒间的相互作用相同 |
NA为阿伏加德罗常数,下列叙述正确的是
| A.1L 0.5mol·L-1氨水中所含NH4+数为0.5NA |
| B.1mol Fe与足量氯气反应转移的电子数为2NA |
| C.标准状况下,33.6L CO2约含有1.5NA个分子 |
D.1 mol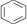 中含碳碳双键数为3NA 中含碳碳双键数为3NA |