(1)实验室用氯化铵固体制取氨气的化学方程式是 。
(2)将4.48L(标准状况)氨气通入水中得到0.05L溶液,所得溶液的物质的量浓度是 。
(3)现有100mL AlCl3与MgSO4的混合溶液,分成两等份。
①向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是 。继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是 ,减少的沉淀的物质的量是 。
②向另一份中加入a mL 1mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
(6分)按下列要求回答:现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘
(1)熔化时不需要破坏化学键的是__________(填序号,下同),沸点最低的是__________。
(2)属于离子化合物的是__________,属于共价化合物的是。
(3)①的电子式是________________,⑤的电子式是________________。
(共6分)如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题: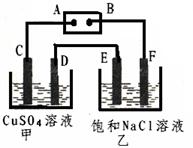
(1)电极A的名称是
(2)甲装置中电解反应的总化学方程式
是
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: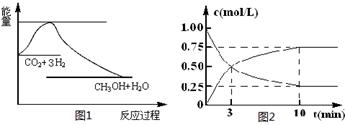
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0B.DH>0,DS<0 C.DH<0,DS<0D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =mol·(L·min)-1;
H2的转化率w(H2) =
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
(共14分)Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是(填序号 )
①碱式滴定管用蒸馏水洗净后没有用标准液润洗
②用酸式滴定管加待测液时,刚用蒸馏水洗净后的滴定管未用待测液润洗
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④滴定前滴定管尖端有气泡,滴定后气泡消失
⑤终点读数时俯视,其他读数方法正确
Ⅱ.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图所示实验装置则可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁。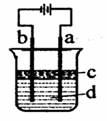
(1)a电极材料为,该电极反应式
(2)若白色沉淀在电极上生成,则电解液d是,若白色沉淀在两极之间的溶液中生成,则电解液d是________(填字母代号)
A、纯水 B、NaCl溶液 C、NaOH溶液 D、CuCl2溶液
(3)液体c为苯,其作用是
(4)若在两极之间的溶液中能短时间内看到白色沉淀,可以采取的措施是________________。
A、改用稀硫酸做电解液 B、适当增大电源电压 C、适当降低电解液温度
(共16分)按要求回答下列问题
(1)用离子方程式解释纯碱溶液去除油污的原因:
(2)写出泡沫灭火器中反应的离子方程式[内液:Al2(SO4)3,外液:NaHCO3]:
(3)SOCl2是一种液态化合物,沸点为77℃。向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2 ,可观察到剧烈反应,液面上有白雾生成,并有无色有刺激性气味气体逸出,该气体中含有使品红溶液褪色的SO2,根据实验现象,写出SOCl2与水反应的化学方程式:
蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H20混合并加热,可得到无水AlCl3,解释原因:
(4)已知:铅蓄电池总的化学方程式为:Pb+PbO2 +2H2SO4  2PbSO4+2H2O
2PbSO4+2H2O
①铅蓄电池在放电时负极反应为,
②铅蓄电池在充电时阳极反应为;
③如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4mol。
(5)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字):
c(OH-)-c(HA)= ___________ mol/L。